Institut Charles Sadron News
Publié le 26/02/2025 par Bigo--Simon Alexis
Les hydrogels supramoléculaires sont des matériaux dont la cohésion est généralement assurée par une architecture nanofibreuse résultant de l’assemblage des briques moléculaires. Lorsqu’ils sont constitués de peptides, ils font l’objet d’un fort engouement en raison de leurs potentielles applications dans le domaine biomédical. Ils pourraient en effet jouer le rôle de matrices pour la libération contrôlée de médicaments ou être utilisés pour la régénération tissulaire grâce à leurs propriétés biomimétiques.
Les propriétés physico-chimiques de ces matériaux trouvent leur origine dans l’organisation spatiale des peptides interagissant entre eux au sein des nanofibres. Si de nombreuses techniques d’analyse spectrale permettent d’apporter des informations sur cet arrangement spatial des peptides, il n’existe aucun outil à disposition du chimiste ou du physico-chimiste qui permette de visualiser de quelle manière ces motifs s’assemblent à l’échelle quasi-atomique. Pourtant, cette information est essentielle pour comprendre, concevoir et optimiser les propriétés et performances des hydrogels supramoléculaires.
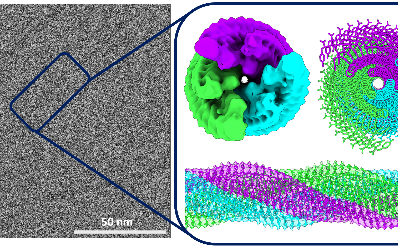
S’inspirant de la résolution de structures iologiques obtenues par reconstruction d’images haute résolution de cryo-microscopie électronique (cryo-ME)1, une approche mise à l’honneur en 2017 par l’attribution du Prix Nobel de Chimie, un consortium d’équipes de recherche2 piloté par l’Institut Charles Sadron (CNRS) pu visualiser la structure d’une nanofibre3 de 4,9 nm de diamètre avec une résolution exceptionnelle de quelques angstrœms. Les scientifiques ont mis en évidence les groupements moléculaires qui contribuent au cœur hydrophobe de la nanofibre et ceux qui interagissent avec l’eau environnante de l’hydrogel. Ils révèlent également une organisation spatiale originale des peptides interagissant entre eux au sein des nanofibres baptisée « fermeture éclair ». Une organisation que l’on retrouve fréquemment dans les associations de motifs en forme d’hélice mais qui n’avait encore jamais été mise en évidence dans ce type de nanostructures organiques supramoléculaires.
Ces travaux sont avant tout le résultat d’une prouesse technique qui illustre le potentiel de la reconstruction par cryo-ME pour répondre à des questions relevant des domaines de la chimie supramoléculaire ou des matériaux mous. Ils contribuent ainsi à une meilleure compréhension de l’assemblage et de l’organisation dans l’espace des peptides et de leurs acides aminés en révélant, avec une résolution rarement atteinte, des motifs supramoléculaires inédits au sein des nanofibres.
Référence
Alexis Bigo-Simon, Leandro F.
Estrozi, Alain Chaumont, Rachel Schurhammer, Guy Schoehn, Jérôme
Combet, Marc Schmutz, Pierre Schaaf & Loïc Jierry
3D
Cryo-Electron Microscopy Reveals the Structure of a
3-Fluorenylmethyloxycarbonyl Zipper Motif Ensuring the Self-Assembly of
Tripeptide Nanofibers
ACS Nano 2024
https://doi.org/10.1021/acsnano.4c08043
- La cryo-microscopie électronique est une technique qui permet de visualiser des échantillons biologiques dans leur natif hydraté. Ces échantillons sont exposés à un faisceau d électrons dans un microscope électronique, et les images obtenues ont traitées pour reconstruire les structures tridimensionnelles.
- Ces travaux de recherche soutenus par la Fondation Jean-Marie Lehn (Labex CSC) et l Agence Nationale de la Recherche ont été menés en étroite collaboration entre l’unité Biomatériaux et bioingénierie (INSERM/CNRS/Université de Strasbourg), l Institut de biologie tructurale de Grenoble (Université de Grenoble, CEA, CNRS), la Faculté de chimie de l Université de Strasbourg (Chimie de la Matière Complexe) et l Institut Charles Sadron (CNRS).
- L assemblage de la nanofibre repose sur l interaction de tripeptides amphiphiles de séquence Phe-Phe-Tyr protégés par un groupement Fmoc en position N-terminale, appelés Fmoc-FFY (Phe ou F, phénylalanine ; Tyr ou Y, tyrosine ; Fmoc, fluorénylméthoxycarbonyle).